A propos de ce blog

Nom du blog :
nezvet
Description du blog :
un blog consacré surtout sur mes etudes de la medecine veterinaire
Catégorie :
Blog Sciences
Date de création :
19.11.2007
Dernière mise à jour :
15.12.2007

>> Toutes les rubriques <<
· Anapath (2)
· Anatomie 2 (0)
· Microbio (0)
· Parasito (5)
· Pharmaco (0)
· Physio-rep (0)
· Physiopath (2)
· Semio BV et CN (2)
Accueil
Gérer mon blog
Créer un blog
Livre d'or nezvet
Contactez-moi !
Faites passer mon Blog !
· LA GALE SARCOPTIQUE CHEZ LE CHIEN
· les chiens
· Cas grave de la gale Psoroptes chez un bovin belge
· La gale chez le bovin
· l'Angiotensine
· diagnostic et traitements "gale"
· La soif
· Cas grave de la gale Psoroptes chez un bovin belge
· Exemples d’une infestation grave par la mite Psoro
· les chiens
· LE VETERINAIRE
· Lésions élémentaires des cellules, tissus et organ
· forum veterinaire
· cours de parasitologie
· baramejnet
· startimes
Statistiques 12 articles
komen gerir la gale
Par Anonyme, le 24.08.2020
philosophie sur les égrégores .
comme nous-nous réincarnons, nos pensées selon quelles soient bonnes ou mauva
Par sainte-trinite, le 04.05.2020
prisca... je traite mon chien qui a la gale avec ivomec sans aucun résultat... maintenant j'utilise forudine c
Par Anonyme, le 04.02.2020
j'ai un berger loup de 2 ans il a le nez et les rebords des yeux qui as des petites croûtes
Par Anonyme, le 13.03.2019
j'offres des prêts allant de 3.000€ à 800.000€ contactez- nous uniquement par mail
Par Chantaledupont8@gm, le 21.11.2017

- · chien terre de neuf
- · schéma de la régulation de l'équilibre hydrominérale
- · medicaments gale chiens
- · système rénine angiotensine aldostérone schéma
- · schéma de la régulation hydro-minéral
- · schemas du systeme renine aldosterone angiotensine
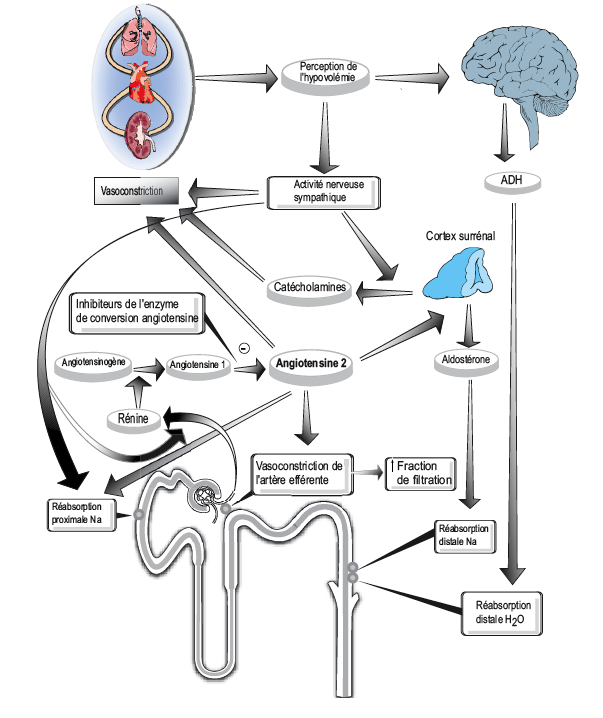
l'Angiotensine
Métabolisme
La biosynthèse de l'angiotensine se fait selon deux voies : la voie classique connue depuis longtemps, mettant en jeu la rénine et l'enzyme de conversion, et une voie de connaissance plus récente, mettant en jeu d'autres enzymes, une chymase jouant le même rôle que l'enzyme de conversion de l'angiotensine et d'autres enzymes permettant la transformation directe de l'angiotensinogène en angiotensine II.
L'angiotensinogène est une glycoprotéine, de poids moléculaire de 50 000 à 100 000, synthétisée par le foie qui la libère dans le plasma. Sa concentration plasmatique est suffisante pour n'être pas le facteur limitant de la formation d'angiotensine I. D'autres tissus, le rein (tubule), les vaisseaux (adventice) et certaines parties du cerveau synthétisent également l'angiotensinogène. La synthèse d'angiotensinogène est augmentée par la prise de glucocorticoïdes et d'estrogènes (contraceptifs).
• La rénine est une enzyme qui assure la production d'angiotensine I à partir de l'angiotensinogène. C'est une protéase acide de type aspartyl de nature glycoprotéique, de poids moléculaire d'environ 40 000, qui coupe la liaison leucine-valine et détache ainsi l'angiotensine I de l'angiotensinogène.
La rénine est synthétisée, sous forme de prorénine, par la partie juxtaglomérulaire du néphron qui la libère dans le plasma sanguin où sa demi-vie est de 15 à 30 minutes et à partir duquel elle se fixe dans les tissus : foie, cœur, vaisseaux. Le rein la synthétise et les autres tissus peuvent la fixer et peut-être même la synthétiser.
• L'enzyme de conversion transforme l'angiotensine I inactive en angiotensine II active et inactive la bradykinine. C'est une enzyme à zinc présente au niveau de l'endothélium vasculaire, plus particulièrement celui des vaisseaux pulmonaires, de l'endocarde, du cerveau. On la trouve également dans le plasma.
• L'aminopepdidase A détache l'acide aspartique de l'angiotensine II qui devient l'angiotensine III.
• La chymase est une enzyme présente dans divers tissus dont le cœur, qui catalyse la transformation de l'angiotensine I en angiotensine II. Son action est spécifique, c'est-à-dire qu'elle n'agit pas sur d'autres substrats tels que la bradykinine. Son activité n'est pas modifiée par les inhibiteurs de l'enzyme de conversion de l'angiotensine.
• D'autres enzymes, comme la cathepsine, peuvent catalyser directement la formation d'angiotensine II à partir de l'angiotensinogène.
La régulation du système est assurée pour l'essentiel par la rénine.
La sécrétion de rénine est augmentée par plusieurs facteurs :
• diminution de la pression artérielle
• diminution de la concentration du sodium plasmatique
• augmentation des catécholamines qui agissent par effet ß
• divers médicaments (anesthésiques généraux, diurétiques).
La sécrétion de rénine est diminuée par certains médicaments : les ß-bloqueurs et les anti-inflammatoires non stéroïdiens.
La deuxième voie semble jouer un rôle certain dans la synthèse d'angiotensine II mais on n'a guère de données concernant la régulation de son fonctionnement. Elle reste fonctionnelle quand la voie rénine/enzyme de conversion de l'angiotensine est inhibée.
Effets
L'angiotensine produit ses effets en stimulant des récepteurs spécifiques appelés AT1 et AT2.
Les récepteurs AT1 sont couplés par l'intermédiaire des protéines G à l'activation de la phospholipase C (hydrolyse de PIP2) ou à l'inhibition de l'adenylcyclase et la stimulation de la voie de signalisation MAP-kinase conduisant à l'activation des proto-oncogènes c-fos et c-jun, notamment au niveau du cœur et des muscles lisses vasculaires. La stimulation des récepteurs AT1 est responsable de la plupart des effets de l'angiotensine II, notamment la vasoconstriction, mais aussi de l'angiogenèse, nécessaire à la croissance tumorale.
Le rôle des récepteurs AT2 est moins connu ; leur stimulation entraînerait une vasodilatation par ouverture de canaux potassiques ou par activation de la guanylate cyclase et un effet antimitogène au niveau de l'endothélium, peut-être par activité protéine phosphatase, neutralisant l'effet des kinases. La densité des récepteurs AT2 est beaucoup plus élevée dans les tissus fœtaux que dans ceux de l'adulte, sans que l'on en sache la raison.
Effets périphériques
Les effets de l'angiotensine sont essentiellement cardiovasculaires.
1. Effet vasoconstricteur
Exprimé en activité molaire, l'effet vasoconstricteur de l'angiotensine II est environ 40 fois plus important que celui de la noradrénaline. Son effet vasoconstricteur (AT1) qui est responsable de son effet hypertensifs, est surtout artériolaire (vaisseaux splanchniques, rénaux et cutanés) mais aussi veineux, ce qui tend à réduire le volume sanguin. L'effet vasoconstricteur de l'angiotensine n'est pas supprimé par les adrénolytiques mais par des antagonistes spécifiques.
Au niveau rénal, l'angiotensine provoque une vasoconstriction de l'artériole efférente (sortie) du glomérule, ce qui permet de maintenir une pression artérielle suffisante pour assurer la filtration glomérulaire, notamment en cas de sténose de l'artère afférente (entrée). Dans ce cas, les antagonistes de l'angiotensine II peuvent, en levant la vasoconstriction de l'artère efférente, faire chuter la pression artérielle au dessous du seuil nécessaire à la filtration et entraîner une insuffisance rénale.
2. Effet cardiaque
L'angiotensine a un effet tachycardisant et faiblement inotrope positif (AT1) mais, in vivo, si l'effet vasoconstricteur est suffisant pour provoquer une hypertension artérielle, on observe une bradycardie réflexe.
D'autre part, l'angiotensine participe directement, en plus des conséquences indirectes de son effet hypertenseur, au développement de l'hypertrophie cardiaque et des lésions athéromateuses vasculaires par son effet de type facteur de croissance (AT1). Elle mettrait en jeu d'une part la voie MAP-kinase par l'intermédiaire de la phospholipase C et de la protéine kinase C, d'autre part la voie JAK/STAT. Cette activation conduit à la transcription de gènes à l'origine de facteurs de croissance.
3. Effet sur l'aldostérone
A doses très faibles non vasoconstrictrices, l'angiotensine II et III stimulent la synthèse et la sécrétion d'aldostérone qui retient le sodium dans l'organisme et favorise l'élimination du potassium (effet AT1).
4. Autre effet
Par ailleurs, l'angiotensine II exerce in vitro une action contracturante sur diverses fibres lisses : iléon, utérus, bronches.
Effets centraux
Les effets centraux de l'angiotensine ont été mis en évidence essentiellement par l'expérimentation animale. Introduite dans des zones particulières du cerveau, l'angiotensine provoque :
• une hypertension artérielle par stimulation du système sympathique et libération de noradrénaline. Cette hypertension est supprimée par les adrénolytiques ;
• un effet dipsogène : augmentation de la soif et de la consommation d'eau;
• une augmentation de la sécrétion de vasopressine et d'ACTH;
• une augmentation de l'appétence sodique.
Le rôle possible du système rénine-angiotensine cérébral en physiopathologie humaine reste à préciser. Certaines études laissent supposer que des inhibiteurs de l'enzyme de conversion comme le captopril auraient un effet antidépresseur et diminueraient le besoin de consommer de l'alcool et peut-être un effet anxiolytique
Bradykinine
La bradykinine est un polypeptide endogène, vasodilatateur, formé de neuf acides aminés (nonapeptide), libéré à partir du bradykininogène ou kininogène des globulines plasmatiques.
Métabolisme
Le kininogène est synthétisé surtout par le foie qui le libère dans le plasma. L'hydrolyse du kininogène par des protéases ou kininogénases, en particulier la kallikréine, donne la bradykinine dont la demi-vie dans le plasma est inférieure à une minute.
La kallikréine serait essentiellement d'origine rénale, mais les mécanismes responsables de la régulation de sa libération sont mal connus. Sa libération serait stimulée par l'élévation de la concentration de potassium.
Effets
Les effets de la bradykinine par stimulation des récepteurs B1 et B2 (à différencier des récepteurs adrénergiques) sont les suivants :
Action cardiovasculaire
• Vasodilatation :
La bradykinine est un des plus puissants vasodilatateurs connus (effet B1). Son effet vasodilatateur, qui est, au moins partiellement, la conséquence de la libération de monoxyde d'azote qu'elle provoque, entraîne une hypotension. La vasodilatation est particulièrement marquée au niveau des capillaires et, chez l'homme, l'injection intraveineuse de bradykinine entraîne une rougeur et une sensation de chaleur au niveau de la face.
• Augmentation de la perméabilité capillaire :
La bradykinine augmente la perméabilité capillaire et favorise le développement de l'œdème.
Elle reproduit les symptômes de l'inflammation et a une action algogène (effet B2).
• Stimulation cardiaque :
La chute de la pression artérielle s'accompagne d'une tachycardie et d'une augmentation du débit cardiaque. Les effets cardiaques s'expliquent par une action indirecte (libération de catécholamines au cours de l'hypotension) mais aussi par une action directe, car la bradykinine accélère et renforce les contractions cardiaques. Elle provoque aussi une vasodilatation coronarienne.
La bradykinine, peut-être par l'intermédiaire de la libération de monoxyde d'azote et de la prostaglandine PGI2, a un effet anti-ischémique cardiaque, supprimé par ses antagonistes (B2).
Action sur les muscles lisses (autres que vasculaires)
L'action de la bradykinine diffère selon les organes et selon les espèces.
Sur l'iléon isolé de cobaye par exemple, la bradykinine fait apparaître une contraction lente à s'établir (d'où l'origine du mot) et le retour à la ligne de base après lavage est également lent.
La bradykinine provoque une bronchoconstriction chez la plupart des espèces et pourrait peut-être jouer un rôle dans certains asthmes et dans le déclenchement de la toux.
Autres actions
La bradykinine stimule la libération de l'hormone antidiurétique et a, dans certaines conditions, une forte action natriurétique.
Elle entraîne une hyperhémie des glandes salivaires.
Médicaments et système rénine-angiotensine-bradykinine
Pour réduire les effets de l'angiotensine II, il y a plusieurs possibilités :
1. Diminuer la synthèse et la libération d'angiotensinogène. Pour le moment, il n'y a pas de médicament agissant spécifiquement par ce mécanisme.
2. Agir sur la rénine
a. Diminuer la synthèse et la libération d'angiotensinogène. Pour le moment, il n'y a pas de médicament agissant spécifiquement par ce mécanisme.
b. Diminuer les effets de la rénine en utilisant des antagonistes spécifiques, c'est-à-dire des inhibiteurs des récepteurs de la rénine, plus simplement appelés inhibiteurs de la rénine. La pepstatine est un des premiers inhibiteurs à avoir été utilisée au cours de diverses investigations, mais elle n'a pas été commercialisée car, étant un pentapeptide, elle est inactive par voie buccale. De nouveaux inhibiteurs de la rénine actifs par voie buccale, en particulier l'aliskiren, (les autres sont l'énalkiren, le rémikiren, le zankiren, terminaison « kiren ») sont en cours d'investigations cliniques. Ils abaissent la pression artérielle, diminuent la concentration d'angiotensine I et II et d'aldostérone mais, comme d'ailleurs les IEC et les antagonistes de l'angiotensine II, ils augmentent la concentration plasmatique de rénine. Leurs indications thérapeutiques devraient être proches de celles des inhibiteurs de l'enzyme de conversion, si leur efficacité et leur bonne tolérance se confirment…
3. Inhiber l'enzyme de conversion. C'est-à-dire inhiber la transformation de l'angiotensine I inactive en angiotensine II active. Les inhibiteurs de l'enzyme de conversion (IEC) sont nombreux et très utilisés en thérapeutique. Il n'y a pas actuellement d'inhibiteur de la chymase.
4. Antagoniser les effets ou certains effets de l'angiotensine II (voir ci-dessous).
5. S'opposer aux effets de l'aldostérone par des antialdostérones (Voir "Minéralocorticoïdes : Aldostérone et Antagonistes".).
On peut également envisager d'inhiber les effets pro-inflammatoires (B2) de la bradykinine. Il n'existe pas actuellement d'antagoniste spécifique de cet effet.
Parmi ces possibilités, celles qui sont exploitées aujourd'hui en thérapeutique sont l'inhibition des effets de l'angiotensine et l'inhibition de l'enzyme de conversion.
LA GALE SARCOPTIQUE CHEZ LE CHIEN
La gale sarcoptique est une infestation de la peau du chien par un acarien parasite, Sarcoptes scabiei variété canis. Elle est responsable de l'apparition d'un prurit (c'est à dire de démangeaisons) très important. Elle est non saisonnière, contagieuse à d'autres chiens et accessoirement à l'homme.
LE PARASITE
Il s'agit d'acariens microscopiques qui se localisent dans la peau. Les adultes mesurent entre 0,2 et 0,4 micromètres, sont de forme ovale et possèdent quatre paires de pattes courtes. Ils sont aisément reconnaissables au microscope (photo 1). Leur cycle de vie dans la peau du chien dure entre trois et quatre semaines. Après un contact sur la surface de la peau, les mâes et les femelles s'accouplent. La femelle fécondée creuse dans l'épiderme une caverne dans laquelle elle pond de nombreux oeufs. En 3 à 10 jours les oeufs éclosent pour donner naissance à des larves vermiformes. Celles-ci remontent à la surface de la peau. Soit elles y forment un cocon, soit elles errent à la recherche de nourriture. Elles muent en nymphe puis en adulte, et sont alors aptes à un nouveau cycle de reproduction.
Le grattage et le léchage engendrés par le parasite provoquent l'ouverture de la caverne. La femelle est alors exposée aux traumatismes et à la dessication, et meurt. Cependant, les oeufs et les feces (excréments) restés à l'intérieur de la peau continuent de provoquer des démangeaisons et donc l'apparition d'excoriations rapidement recouvertes de croûtes.
Le parasite déclenche la maladie de deux façons : d'abord par une action mécanique (la femelle creuse sa galerie dans l'épiderme ce qui irrite la peau) et ensuite en suscitant une réaction "allergique". En effet la salive, les produits de sécrétion et d'excrétion, les liquides de mue et les protéines du chien dénaturées par la digestion du Sarcoptes sont des substances, qui induisent chez l'hôte infesté une réaction anormale dite d'"hyper-sensibilité". Ces substances provoquent en fait des réactions anormales de l'organisme, à l'origine de la libération de certains médiateurs, directement responsables de l'aggravation des signes cliniques.
TRANSMISSION
La gale sarcoptique est hautement contagieuse et la transmission se fait en général par simple contact d'animal infesté à animal sain. La transmission peut également avoir lieu via le matériel utilisé sur les animaux. Ainsi, les brosses et le matériel de pansage peuvent être source d'infestation. De plus Sarcoptes scabiei var. canis peut survivre 24 à 36 heures dans le milieu extérieur à la température de 20°C et jusqu'à 19 jours si la température est basse (10°C) et le degré d'hygrométrie élevé (97 %). Le transport dans des cages contaminées ou l'utilisation de boxes ou de chenils non désinfectés ni traités avec des acaricides peut donc aussi être responsable de contagion.
Le parasite est attiré vers l'hôte par de nombreux stimuli dont la température corporelle. Les Sarcoptes sont considérés comme relativement spécifiques du chien, mais ils peuvent aussi contaminer l'homme, et, tout à fait exceptionnellement, être transmis au chat.
Les propriétaires de chiens galeux sont donc parfois infestés par le parasite. Ils présentent alors une éruption papulocroûteuse ("boutons de gale") très prurigineuse, surtout la nuit (les parasites seraient plus actifs à la chaleur).
TRAITEMENT
Le traitement doit être effectué chez l'animal malade et chez tous les chiens de la maison devant la grande contagiosité de la dermatose. Il doit inclure le traitement de l'environnement où vit l'animal, puisque les parasites survivent dans le milieu extérieur.
On peut utiliser un traitement par voie générale en injections, à base d'un antiparasitaire systémique acaricide. Tous les chiens sauf les Colley, les Shetland, les Bobtail et leurs croisés peuvent être traités par cette méthode. Un traitement symptomatique peut être associé, notamment des shampooings et des réhydratants antiséborrhéiques et calmants. Ceux-ci améliorent l'état du pelage et restaurent un bon équilibre cutané.
Dans le cas où ce traitement n'est pas applicable ou non souhaité, il faut couper les poils, faire un shampooing antiséborrhéique pour éliminer les squames et les croûtes puis appliquer un acaricide topique. Cette application doit être très soigneuse et rigoureuse : il faut traiter chaque partie du corps, "du bout du nez au bout de la queue". Il faut frotter énergiquement avec une brosse pour faciliter la pénétration de l'acaricide et bien insister sur les zones périorbitaires et les pavillons auriculaires, où les parasites sont nombreux. Ce traitement doit être répété plusieurs fois (en moyenne 10 fois à trois jours d'intervalle) et en tout état de cause devra être prolongé après la guérison clinique.
Il est à noter qu'une exacerbation du prurit peut exister dans les premiers jours suivant l'instauration du traitement quel qu'il soit ("prurit postscabieux"). Cette augmentation des démangeaisons est due à la mort des parasites qui libèrent dans la peau de nombreuses substances allergisantes.
Les locaux doivent être lavés puis traités par des pulvérisations de solutions acaricides et insecticides.
Le traitement des humains contaminés n'est pas nécessaire, car les parasites du chien ne peuvent pas survivre dans la peau de l'homme. Ainsi, après traitement de l'animal, les lésions humaines disparaissent et ne réapparaissent pas.
LA PREVENTION
La gale sarcoptique se rencontre souvent chez de jeunes animaux, et sa grande contagiosité en fait une maladie des groupes et des élevages. Il faut donc y penser en présence d'une dermatose qui semble contagieuse chez un chiot ou un jeune chien. De la même façon, après un séjour en chenil, un chien peut avoir été contaminé, et il faudra donc être vigilant à l'apparition éventuelle de démangeaisons. Ces symptomes justifient la consultation d'un vétérinaire.
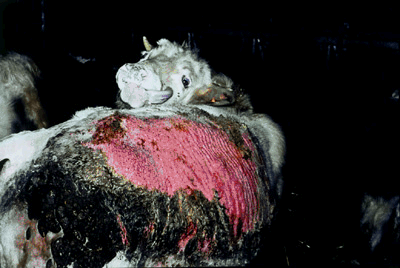
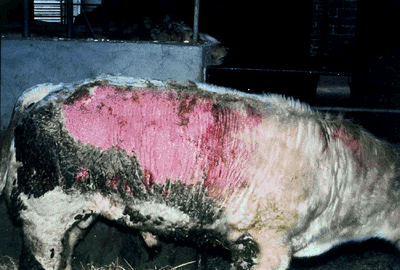
La gale chez le bovin
Les animaux atteints de gale présentent des démangeaisons intenses, sont agités, mordent et se frottent aux parties infestées jusqu’à s’en arracher la peau. Les jeunes animaux maigrissent fortement ce qui ralenti la croissance et peut mener à la mort dans des cas sévères.
Les bovins belges blancs bleus souffrent le plus de la gale parce que certains animaux présentent une réaction inflammatoire très sévère sur les parties atteintes de la peau. On doit considérer ces réactions inflammatoires comme une allergie ou une réaction d’hypersensibilité. On peut conclure que les bovins avec des lésions de gale sont infestés de mites, mais aussi que leurs compagnons qui ne présentent pas de lésions sont souvent porteurs de beaucoup plus de mites et sont beaucoup plus contagieux. Pour cela il est avisé de toujours prendre des mesures chez tous les animaux de l’élevage.[/SIZE]
La gale Psoroptes fait souvent maigrir les bovins. Des recherches indiquent que chaque bovin infesté qui n’est pas traité gagne en moyenne 300gr de moins en poids pour chaque 10% de la surface du corps qui sont atteints. Dans des cas négligeables la gale de Psoroptes peut épuiser et même tuer le bovin.
La gale Chorioptes: patte, arrière-train et base de la queue.
La gale Sarcoptes: les parties non poilues de l’animal: le pis, le cou et la tête.
Diagnostic
En cas d’analyse parasitologique, on prélève un grattement à l’endroit de la lésion de gale. Dans un laboratoire on peut assez facilement discerner les trois espèces les unes des autres par une analyse microscopique. Psoroptes et Chorioptes se produisent fréquemment et souvent ensemble. Le diagnostic pour établir de quel acarien il s’agit est toujours très important.
Exemples d’une infestation grave par la mite Psoro
Cas grave de la gale Psoroptes chez un bovin belge
Cas grave de la gale Psoroptes chez un bovin belge
diagnostic et traitements "gale"
1. Diagnostic clinique
L'incubation est de 3 semaines en moyenne lors d'une première contamination et plus courte en cas de re contamination.
1.1. Gale commune
1.1.1. Gale commune (nourisson exclu) :• Prurit, quasi-constant, à recrudescence nocturne
• Lésions spécifiques qui ne sont pas constamment retrouvées : sillons, vésicules perlées, papulo-nodules
• Lésions non spécifiques plus fréquemment constatées : lésions eczématiformes et de grattage, impétigo
• Topographie évocatrice : espaces interdigitaux dorsaux des mains, aréole mammaire, organes génitaux externes (papulo-nodules), partie basse des fesses, coudes, zones axillaires antérieures. Le dos et le visage sont respectés
1.1.2. Gale commune du nourisson :• L'éruption est le plus souvent vésiculo-pustuleuse, parfois papuleuse, prurigineuse prédominant aux extrémités mais pouvant être plus diffuse. Le visage est habituellement épargné, une atteinte du cuir chevelu est possible,
• Les sillons sont inconstants mais des nodules inflammatoires et prurigineux, (nodules scabieux), prédominants aux aisselles, au bas du dos et aux organes génitaux ne sont pas exceptionnels. Ils peuvent être la seule manifestation clinique et persister plusieurs semaines.
• Le prurit isolé n'est pas un mode révélateur de l'affection.
• Une surinfection cutanée (impétiginisation) est fréquente, peut majorer l'éruption pustuleuse et entraîner adénopathies et fièvre.
1.2. Gales profuses
Souvent d'aspect trompeur, les gales profuses sont très contagieuses :
[u]
1.2.1. Gale disséminée inflammatoire[/u]
L'atteinte du dos y est fréquente. Elle est préférentiellement observée chez les personnes âgées, en collectivité.
1.2.2 Gale hyperkératosique
Elle peut être généralisée ou localisée. Les squames friables sont prédominantes, le prurit est parfois absent. L'immunodépression locale et ou générale constitue un facteur favorisant (corticothérapie, infection par le VIH...).
Le retard diagnostique est source d'épidémie.
2. Conduite à tenir
Il n'y a pas de guérison spontanée de la maladie. Le traitement est justifié lorsque le diagnostic de gale est établi sur les éléments suivants :
• présence des lésions cliniques évocatrices et/ou mise en évidence du parasite ou de ses œufs ou de ses déjections (syballes)
• En l'absence de prurit, il faut exiger un examen parasitologique positif
• Dans tous les cas la notion de contage et de prurit dans l'entourage est un élément très évocateur du diagnostic
• Le traitement d'épreuve à visée diagnostique doit être évité : en effet, un prurit d'autre étiologie peut céder sous ce traitement, inversement le prurit de la gale peut être long à disparaître.
2.1. Qui traiter ?
2.1.1 Gale commune
Le médecin doit définir les personnes à traiter dans l'entourage familial et extra familial qui doivent être traités simultanément avec le sujet parasité : en règle générale, toute personne ayant eu un contact intime avec le malade (cf. § mode de transmission)
2.1.2 Gales profuses
Le sujet parasité doit être hospitalisé et traité en chambre individuelle.
• En raison de la très forte contagiosité, la définition des sujets contacts à traiter doit être large.
• S'il s'agit d'une gale en collectivité, une stratégie de prise en charge de type épidémie doit être mise en place par le médecin traitant, le responsable de l'établissement et les autorités sanitaires. Les familles doivent être prévenues. En fonction du nombre et de la dissémination des cas dans la collectivité, doivent être traités au minimum toutes les personnes en contact avec le malade et au maximum toutes les personnes vivant, travaillant ou visitant l'institution et le cas échéant leur propre entourage.
2.2. Comment traiter ?
2.2.1 Les traitements
Il y a deux types de traitements :
• Le traitement per os. : à ce jour, seule l'ivermectine est disponible, en prise unique 200 µg / kg. La sécurité de l'emploi n'a pas été établie chez l'enfant de moins de 15 kg
• Les traitements locaux :
o Le benzoate de benzyle.
o Les pyréthrinoïdes de synthèse : seule l'esdépalléthrine est disponible en France dans cette indication. Elle est contre-indiquée en cas d'asthme et de bronchite asthmatiforme, ainsi que sur le visage, en raison de sa galénique en spray.
o Le lindane, contre-indiqué chez le nourrisson (la commission d'Autorisation de mise sur le marché a proposé d'inscrire le lindane dans la liste 1 des "substances vénéneuses" : nécessité d'ordonnance le plus souvent sans possibilité de renouvellement).
Les traitements locaux peuvent être irritants, d'autant plus qu'ils sont répétés.
Les différents types de produits figurent dans le tableau présenté en annexe.
En cas d'impétiginisation, un traitement antibiotique est donné per os.
2.2.2 Les traitements
Toutes les régions du corps doivent être traitées, y compris le cuir chevelu et le visage s'il y a un doute sur leur atteinte.
• Gale Commune :
o Le traitement est fait à domicile.
o Dans l'état actuel des connaissances, il n'y a pas de niveau de preuve suffisant pour préférer un traitement par voie locale ou per os. Cependant la facilité d'utilisation plaide en faveur du traitement per os et ce d'autant plus que le nombre de personnes à traiter est important.
o Quelque soit le traitement choisi, les vêtements, les draps, les serviettes, doivent être lavés, si possible en machine; il n'y a pas lieu de désinfecter plus largement l'environnement.
• Gales profuses :
o Le malade doit être isolé (le plus souvent lors d'une hospitalisation).
o Le traitement per os est recommandé. En l'absence de schéma thérapeutique validé, l'association à un traitement local et leur répétition (cf. 4.3) peuvent être envisagées.
o La décontamination des lieux de vie par un acaricide est à décider avec les autorités sanitaires.
2.3. Qui retraiter ?
• Tous les sujets qui ont des signes cliniques spécifiques de gale et/ou un examen parasitologique positif persistant 8 à 15 jours après le traitement ; les causes peuvent être la survenue d'une résistance, d'une ré- infestation ou un traitement insuffisant (incompréhension ou mauvaise observance).
• Dans les gales profuses, une deuxième dose du traitement per os et/ou l'association à un traitement topique peut être nécessaire pour obtenir la guérison.
Le CSHPF indique que
• La persistance d'un prurit dans les 8 à 15 jours après le traitement, ne traduit pas forcément un échec. Il peut être dû à :
o une irritation cutanée par le traitement.
o un eczéma de contact.
o une acarophobie.
o Les autres causes de prurit masquées par la gale.
• Des nodules post scabieux peuvent persister plusieurs semaines après un traitement, en particulier chez le nourrisson. En l'absence d'autre signe de gale, le re-traitement n'est pas justifié.
• Chez le nourrisson, on peut observer des pustules palmo-plantaires post-scabieuses ne justifiant pas d'un traitement spécifique.
les chiens
les chiens
2. Collie
3. Lévrier
4. Terrier
5. Bouledogue
6. Bichon maltais
7. Terre-Neuve
8. Boxer
9. Dobberman
10. Dalmatien
11. Saint-Bernard
12. Husky
13. Samoyède
14. Chow chow
15. Teckel
16. Berger allemand
La soif
Si on peut survivre plusieurs semaines sans apports alimentaires (jeûne prolongé), sans liquide, en revanche, on ne tiendrait pas plus de 3 jours.
L’organisme possède un véritable système d’alarme qui régule notre comportement de prise de boisson, en fonction des nécessités du milieu intérieur.
Le maintien des niveaux d’eau ou de la balance hydrique (ou équilibre hydrique) est vital pour la survie de nos cellules et donc la survie de notre organisme.
Introduction-notion de soif volumétrique
La nécessité de boire dépend de 2 paramètres du milieu Intérieur:
- du volume sanguin (Volémie)
- concentration en substances dissoutes (Osmolarité)
Le maintien de ces 2 paramètres constitue l’homéostasie hydrominérale (ou équilibre hydrominéral). Cette équilibre est indispensable pour la survie de nos cellules.
Il existe donc des mécanismes compensateurs permettant d’ajuster les entrées et les sorties d’eau, mais aussi de la concentration en solutés des liquides de l’organisme.
Naissance de la sensation de soif
La sensation de soif peut donc avoir 2 origines:
1.1- Baisse du volume extracellulaire suite à une perte du volume générale des liquides de l’organisme: Soif volumétrique
Signal: diminution de la pression artérielle
1.2- Baisse du volume intracellulaire suite à une augmentation de la concentration en soluté des liquides extra-cellulaires: Soif Osmotique
Signal: augmentation de la pression osmotique du plasma
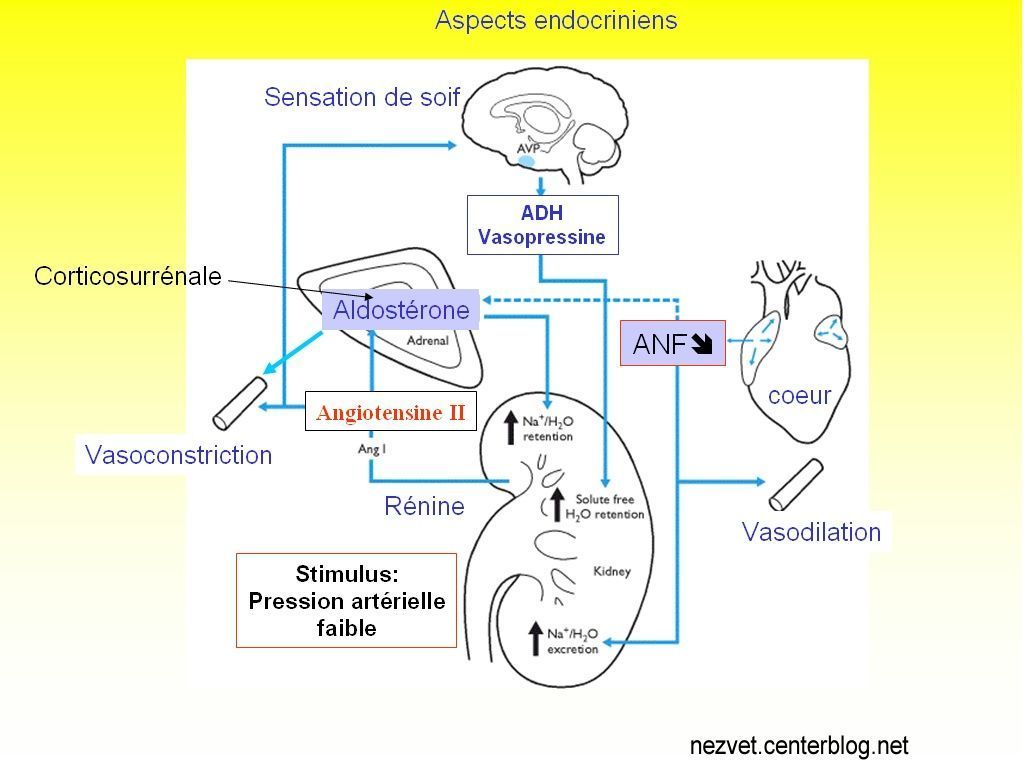
Système rénine-angiotensine
La réduction de l’afflux sanguin dans les reins provoque la sécrétion d’une hormone, la rénine.
La rénine transforme l’Angiotensinogène (libéré par le foie dans le sang) en angiotensine I qui se transforme alors en Angiotensine II.
L’angiotensine II agit au niveau central sur l’organe subfornical (parois des ventricules-parois minces), dont les neurones vont générer une sensation de soif pour les liquides salés (hypothal.).
Ces neurones vont stimuler les cellules magnocellulaires neurosécrétrices d’ADH de l’hypothalamus.